Woda i jej właściwości
Woda jest najbardziej rozpowszechnionym, najbardziej znanym i jednocześnie najbardziej zagadkowym płynem na Ziemi, a możliwe, że nie tylko na tej planecie. Jej właściwości znacznie odbiegają od właściwości innych substancji o podobnej budowie. Z tego powodu woda w temperaturze pokojowej jest cieczą, co warunkuje właściwe funkcjonowanie organizmów żywych. Jakim właściwościom wody zawdzięczamy jej powszechną obecność w naszym życiu?

Woda jest substancją niezwykłą, a my przyzwyczajeni do niej, nawet nie zdajemy sobie z tego sprawy. Nawet tak oczywista rzecz jak to, że lód unosi się na powierzchni wody w stanie ciekłym jest w świecie materii czymś bardzo wyjątkowym.
Budowa cząsteczki wody
Woda jest substancją zbudowaną z cząsteczek. Każdą cząsteczkę tworzą dwa atomy wodoru połączone z jednym atomem tlenu. Pomiędzy atomami tlenu i wodoru występują wiązania kowalencyjne spolaryzowane. Atomy wodoru i tlenu nie leżą w jednej linii, wiązania pomiędzy nimi tworzą kąt około 104,5°.
Cząsteczka wody
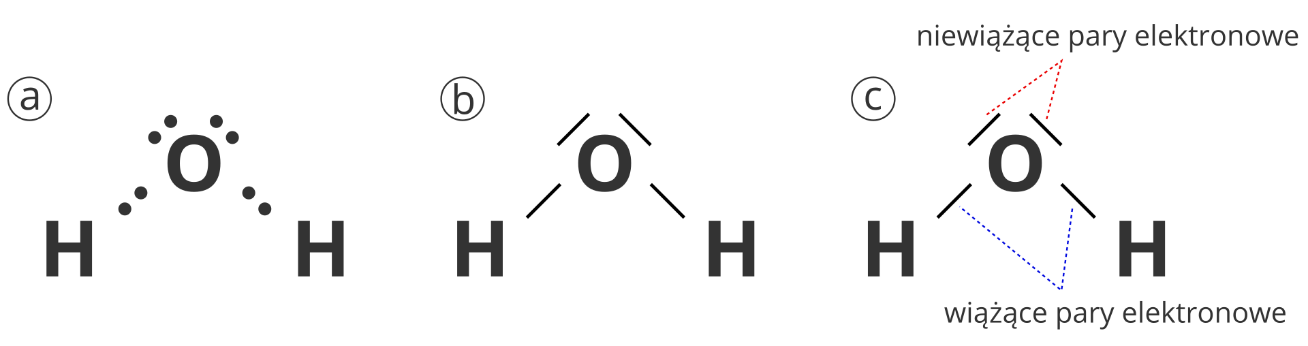
Budowa cząsteczki wody: wzór elektronowy kropkowy (a), wzór elektronowy kreskowy (b), rodzaje par elektronowych w cząsteczce wody i wielkość kąta pomiędzy wiązaniami (c).
Cząsteczka wody jest polarna
W cząsteczce wody atom tlenu ma silniejsze zdolności do przyciągania elektronów niż atom wodoru, dlatego wspólne pary elektronowe są przesunięte w kierunku atomu tlenu. Z tego względu jądro atomu wodoru jest częściowo „odsłonięte”, jego dodatni ładunek nie jest w pełni „zobojętniony” przez ujemny ładunek elektronu. Atom wodoru zyskuje ładunek dodatni, którego wartość jest mniejsza od elementarnego ładunku dodatniego (ładunku protonu), stanowi tylko jego część, dlatego mówi się, że na atomie wodoru występuje cząstkowy ładunek dodatni. Przy atomie tlenu występuje nadmiar ładunku ujemnego, a jego wartość jest mniejsza od ładunku elektronu.
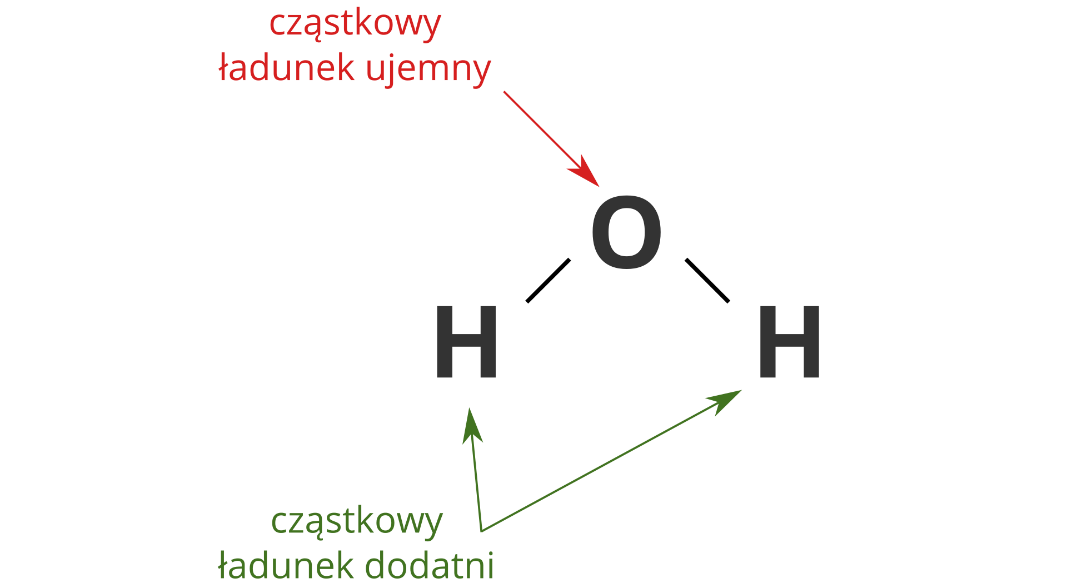
Cząstkowe ładunki, ujemny na atomie tlenu i dodatnie na atomach wodoru, równoważą się i cząsteczka wody jest elektrycznie obojętna.
Zachowanie się cząsteczek w różnych stanach skupienia wody
Jak wiemy, ładunki różnoimienne (dodatni i ujemny) wzajemnie się przyciągają. Tak dzieje się również w przypadku cząsteczek wody – atom wodoru jednej cząsteczki może oddziaływać elektrostatycznie z atomem tlenu drugiej cząsteczki. Takie zjawisko można wyraźnie zaobserwować w wodzie w stanie ciekłym i stałym. W wodzie w fazie ciekłej obok wolnych cząsteczek występują także ich skupiska, które tworzą się właśnie dzięki przyciąganiu elektrostatycznemu. Skupiska te nie są trwałe. Jedne cząsteczki uwalniają się z nich, inne zaś dołączają do układu. W stanie stałym cząsteczki wody dzięki oddziaływaniom elektrostatycznym tworzą stosunkowo trwałe struktury.
Zjawisko łączenia się drobin (cząsteczek, jonów, atomów) w większe układy złożone z dwóch lub większej liczby cząstek w wyniku elektrostatycznych oddziaływań nosi nazwę asocjacji.
Jak polarna budowa cząsteczek wody wpływa na gęstość tej substancji?
Polarna budowa cząsteczek wody ma swoje konsekwencje – są nimi właściwości fizyczne wody. Zazwyczaj jest tak, że w ciele stałym drobiny znajdują się bliżej siebie niż w cieczy i substancja w stanie stałym ma większą gęstość niż w stanie ciekłym. W przypadku wody cząsteczki w fazie stałej tworzą struktury, które pozostawiają dużo wolnej przestrzeni, przez co odległości między cząsteczkami są większe w lodzie niż w wodzie. Z tego powodu lód ma mniejszą gęstość niż woda ciekła.

Lód ma mniejszą gęstość niż woda ciekła i dlatego unosi się na jej powierzchni.
Niska w stosunku do gęstości ciekłej wody, gęstość lodu ma bardzo ważne znaczenie dla istnienia życia wodnego na Ziemi. Lód, który tworzy się na powierzchni wody, izoluje jej głębsze warstwy i chroni je przed zamarzaniem. Umożliwia w ten sposób egzystencję organizmom wodnym w czasie mrozów.
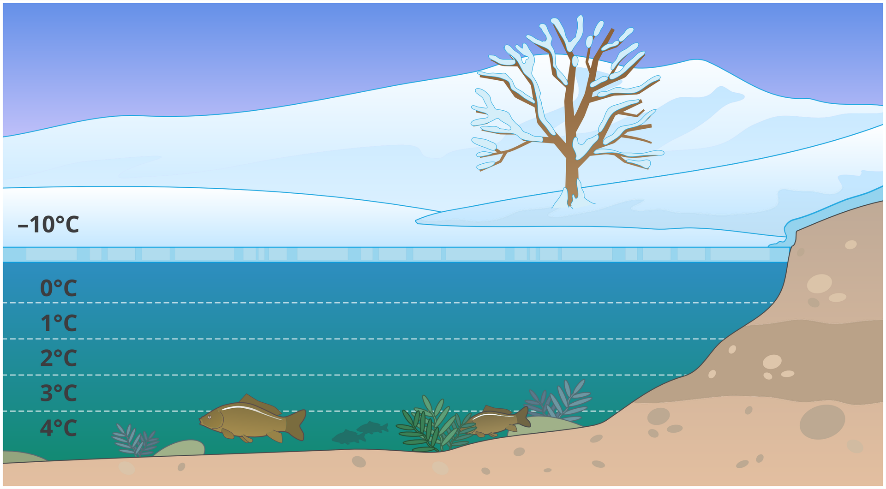
W mroźne dni lód chroni życie wodne w zbiorniku. Pod nim temperatura wody wynosi zawsze około 0°C, a na dnie zaś sięga około 4°C.
Ciekawostka
Klatraty metanu
Cząsteczki wody mogą tworzyć regularne struktury w postaci klatek, w których uwięzione są inne małe cząsteczki substancji. Powstałe kryształy nazywane są klatratami. Największe zainteresowanie wzbudzają klatraty metanu, czyli struktury lodu, w których uwięziony jest metan, główny składnik gazu ziemnego. Nazywane są metanowym lodem. Ich największe pokłady znajdują się na dnie mórz i oceanów, a także pod wieczną zmarzliną. Metanowy lód utworzył się pod wpływem wysokiego ciśnienia wody i metanu pochodzącego z beztlenowego rozkładu materii organicznej. Podejmowane są próby pozyskania z klatratów metanu jako cennego paliwa. Naukowcy pracują nad nowymi technologiami, które umożliwiłyby wydobycie metanu. Jednocześnie ekolodzy ostrzegają, że eksploatacja złóż klatratów mogłaby zaburzyć stabilność dna morskiego i wywołać pośrednio wiele niepożądanych zmian w środowisku.

Metanowy lód to białe kostki wyglądem przypominające lód. Takie kryształy zmrożonej wody i gazu mogą w sprzyjających warunkach (pod wysokim ciśnieniem i w niskiej temperaturze) przetrwać na dnie morza miliony lat
Jak polarna budowa cząsteczek wody wpływa na temperaturę topnienia i wrzenia tej substancji?
Zrozumienie właściwości fizycznych wody będzie łatwiejsze, jeśli przypomnimy sobie kilka faktów na temat stanów skupienia materii. W ciele stałym drobiny substancji są położone blisko siebie i nie przemieszczają się. W cieczy drobiny znajdują się w większych odległościach od siebie, poruszają się i zderzają się ze sobą bardzo często. Gdy substancja jest w stanie gazowym, jej drobiny znajdują się daleko od siebie, przemieszczają się po torach prostych i z uwagi na dostępną wolną przestrzeń rzadziej zderzają niż w stanie ciekłym.
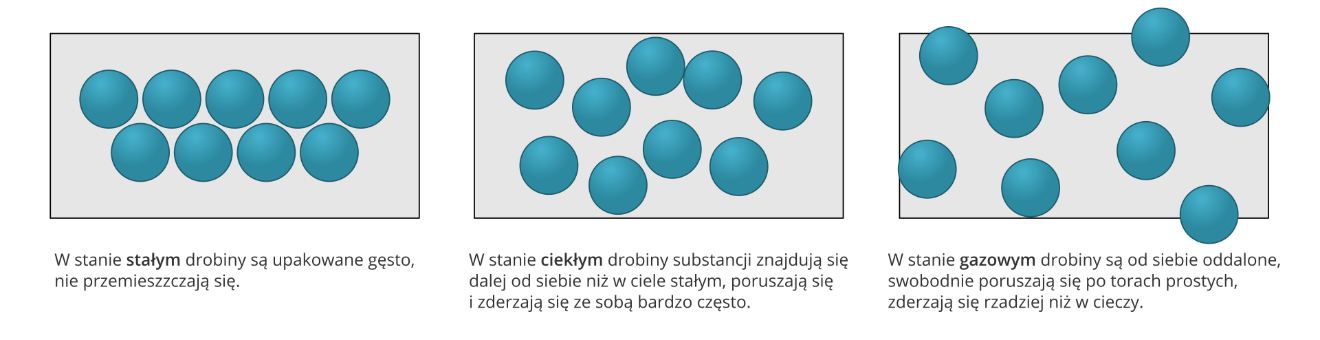
Model upakowania drobin substancji znajdującej się w stanie: a) stałym, b) ciekłym, c) gazowym
Gdy substancja zmienia swój stan skupienia ze stałego w ciekły, a następnie gazowy, musi być dostarczana energia po to, by cząsteczki mogły się od siebie oddalić. Im więcej energii należy dostarczyć, tym substancja ma wyższą temperaturę topnienia i wrzenia.
Podczas przechodzenia lodu w ciecz cząsteczki wody muszą uwolnić się od odziaływań elektrostatycznych, a następnie otrzymać energię, która pozwoli im na przemieszczanie się. Podobnie podczas parowania cząsteczki wody muszą uzyskać energię potrzebną do pokonania sił elektrostatycznych oraz niezbędną do oddalenia się od siebie na duże odległości i poruszania się. Dlatego woda ma stosunkowo wysoką temperaturę topnienia i wrzenia. Znacznie wyższą niż substancje o podobnej budowie, których cząsteczki nie oddziałują między sobą, np. chlorowodór, czy siarkowodór.
Składniki roztworu wodnego
Wiemy już, że mieszaniny jednorodne to takie, których składników nie można rozróżnić gołym okiem lub za pomocą prostych przyrządów optycznych. Nazywa się je roztworami właściwymi, rzeczywistymi lub – ogólnie – roztworami. Wszystkie roztwory składają się z następujących składników: rozpuszczalnika i substancji rozpuszczonych.
W mieszaninie wody z cukrem spożywczym rozpuszczalnikiem jest woda, a substancją rozpuszczoną – sacharoza (główny składnik cukru spożywczego).
Jakie procesy mogą zachodzić podczas rozpuszczania substancji w wodzie?
Woda jest najbardziej rozpowszechnionym rozpuszczalnikiem zarówno w przyrodzie, jak i w laboratoriach.
Wiele substancji, które tworzą w wodzie roztwory właściwe, ulega podczas rozpuszczania różnym procesom.
Woda rozpuszcza substancje, które tak jak ona są polarne. Ponadto dobrze rozpuszcza większość związków jonowych. Polarne związki kowalencyjne mogą zachowywać się różnie w wodzie: niektóre pozostają w niej jako cząsteczki (np. sacharoza), inne zaś mogą ulec pod jej wpływem rozpadowi na jony (np. chlorowodór). Związki jonowe, jeśli rozpuszczają się w wodzie, podczas mieszania się z nią ulegają rozpadowi, a jony z sieci krystalicznej przechodzą do roztworu.
Zapamietaj!
Woda jest substancją polarną. Na atomie tlenu znajduje się cząstkowy ładunek ujemny, na atomach wodoru – dodatni.
Cząsteczki wody w wodzie w fazie ciekłej oddziałują ze sobą: atom wodoru jednej cząsteczki oddziałuje elektrostatycznie z atomem tlenu drugiej cząsteczki i obok wolnych cząsteczek występują ich skupiska, które utrzymują się dzięki przyciąganiu elektrostatycznemu.
Cząsteczki wody w lodzie tworzą uporządkowane struktury, w których są od siebie oddalone na większą odległość niż w wodzie w stanie ciekłym. Lód ma mniejszą gęstość niż woda.
W roztworach właściwych wyróżniamy rozpuszczalnik, który znajduje się w przewadze w stosunku do substancji rozpuszczonej.
Woda rozpuszcza substancje, które tak jak ona są polarne. Rozpuszcza też większość związków jonowych.
Źródło: ZPE